Tempo fa, un amico (ingegnere) mi chiese se ero ancora in grado di spiegare a sua figlia (universitaria) gli orbitali e i numeri quantici.
E’ stata l’occasione di un ripasso dei vecchi libri universitari.
Menù.
Stati stazionari
Orbitali
Numero quantico (n)
Numero quantico (l)
Tipi di orbitali
Cenni sulla teoria ondulatoria dell’atomo
Numero quantico (m)
Numero quantico (ms) spin
Forma degli orbitali
Scrittura dell’atomo
Al liceo ci avevano spiegato che gli elettroni giravano come trottole attorno al nucleo in una orbita che possiamo immaginare come un sistema planetario dove i pianeti girano attorno al Sole.
Era il modello atomico di Rutherford. Un modello “planetario” o a gusci concentrici. Poi arriviamo alla università e scopriamo che gli elettroni non si muovono attorno a orbite fisse come un treno lungo i binari, ma si allontanano e si avvicinano al nucleo ad una velocità prossima a quella della luce.
Questo determinava il fatto che era praticamente impossibile determinare contemporaneamente la loro posizione e la loro velocità (principio di indeterminazione di Heisenberg). Questi stati furono chiamati stati stazionari.
Fu N. Bohr nel 1913 a fornire quelle basi teoriche che mancavano che hanno costituito il punto di partenza per un vertiginoso progresso scientifico degli ultimo cinquanta anni.
Partendo dall’ammissione che nell’atomo gli elettroni non irradiano necessariamente energia, ipotizzò che, in contrasto con le teoria elettromagnetica classica, esistessero alcuni stati, tra gli infiniti possibili, nel quale l’elettrone potesse muoversi senza emettere energia conservando costante la propria energia totale (cinetica + potenziale).
Ma scopriamo dell’altro. Di ogni elettrone possiamo definire lo spazio o la nuvola tridimensionale attorno al nucleo all’interno della quale abbiamo una elevata probabilità di trovare l’elettrone. E’ come se l’elettrone fosse “confinato” all’interno di una nube di dimensioni, forma e orientamento spaziale definito matematicamente chiamato “orbitale”.
L’orbitale è quindi quella porzione di spazio tridimensionale disposta attorno la nucleo, all’interno della quale abbiamo un’alta probabilità di trovare l’elettrone.
Il valore (modulo) del momento angolare di un corpo di massa “m” che ruota lungo una circonferenza con raggio “r” con velocità “v” è dato dal prodotto “mvr”, ovvero del prodotto della quantità di moto “mv” per il raggio “r”.
Bohr ipotizzo che la condizione perché un elettrone muovendosi su una orbita non emetta energia è che il valore del momento angolare dell’elettrone che percorre l’orbita ha un valore ben definito e sia multiplo di un grandezza intera finita. Questa condizione implica che il momento angolare dell’elettrone non può assumere tutti i valori possibili, ma soltanto alcuni.
Questa limitazione significa quantizzate il momento angolare. Questo può variare solo per “quanti” multipli interi di un valore minimo: h/2π (dove h è la costante di Plank).
Pertanto secondo Bohr la quantizzazione assume questi valori:
mvr = n h/π per n= 1, 2, 3 …..
Ora affinché l’elettrone (negativo) resti in equilibrio sulla sua orbita la forza coulombiana che lo attrae verso il nucleo (positivo) deve essere uguale alla forza di inerzia diretta verso il raggio e volta verso l’esterno che tende ad allontanarsi da esso.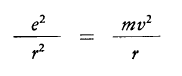
Siccome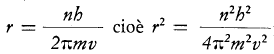
Si ricava facilmente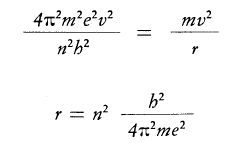
La espressione nella quale non compare più la velocità dell’elettrone indica che anche i raggi delle orbite sono quantizzati e assumono solo valori “discreti” in funzione di “n” che viene chiamato numero quantico principale.
L’unico elettrone dell’atomo dell’idrogeno quindi può assumere solo i seguenti valori.
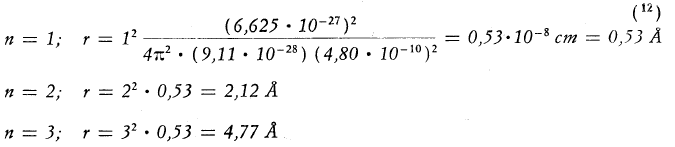
Il numero quantico principale (n) è quindi associato alla dimensione dell’ orbitale, al crescere di (n) aumenta la distanza dell’elettrone dal nucleo e il suo livello di energia. In teoria (n) può assumere valori interi positivi da 1 all’infinito, ma di fatto, quando un atomo è nel suo stato fondamentale, il numero di (n) può arrivare fino a 7.
Uguale ragionamento si può fare sulla energia potenziale (V=-e2/r) e energia cinetica (T=mv2/r).
Per V=T , equilibrio delle energie, si ottiene: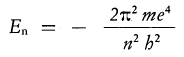
Che esprime la quantizzazione dell’energia dell’elettrone dell’atomo di idrogeno.
Di conseguenza se si vuole eccitare un elettrone per farlo saltare alla sua orbita superiore n=2, la espressione ci dice di quanta energia abbiamo bisogno, che come si vede è quantizzata per pacchetti finiti a seconda il livello.
L’elettrone eccitato tende poi a tornare spontaneamente allo stato di minore energia n=1 rimettendo sotto forma di radiazione la energia assorbita per l’eccitazione.
A questo va aggiunto che ad una radiazione di frequenza “ν” è associato un quanto di energia “ε” (ε = hν).
Per fornire all’elettrone energia radiante è necessario fornirsi di una radiazione con una frequenza opportuna.

La teoria di Bohr si dimostro presto insufficiente a spiegare il comportamento di atomi più complessi dell’idrogeno contenenti più di un elettrone. Gli spettri di questi atomi mostravano raggruppamenti di righe ravvicinate tra loro non interpretabili con la teoria di Bohr.
La spiegazione fu trovata da A. Sommerfeld il quale nel 1915 applicò agli elettroni degli atomi le leggi di Keplero. Ipotizzo che nell’atomo gli elettroni percorressero orbite ellittiche di cui il nucleo occupi uni dei fuochi. Fu necessario un ulteriore numero quantico per la quantizzazione della eccentricità (e quindi della forma) dell’ellisse che l’elettrone può percorrere nei suoi stati stazionari.
Sommerfeld mostrò che i numeri quantici (n) e (l) non possono assumere valori a piacere, ma solo alcuni valori dipendenti tra loro.
Per ogni valore di (n), (l) può assumere valori compresi da 0 a (n-1).
n = 1, 2, 3, 4 …..
l = 0, 1, 2, 3 …….
Questo significa che per un elettrone sul livello n=2, (l) può assumere l=0, l=1.
A questi valori di numeri quantici corrispondono due orbite:
n=2; l=0
n=2; l=1
differenti per la forma dell’orbita ed anche per la energia: E20, E21.
Secondo la teoria di Bohr sullo stato quantico n=2 l’elettrone avrebbe posseduto solo il livello di energia E2.
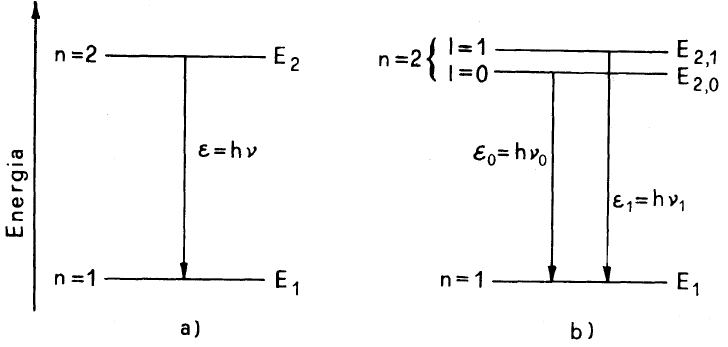
Nella figura a) Unica riga spettrale di frequenza ν secondo Bohr.
Nella figura b) Due righe spettrali secondo Sommerfeld.
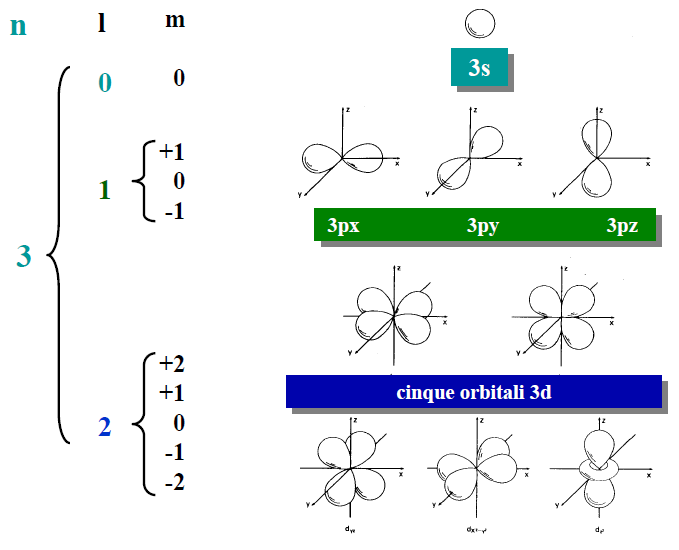
I diversi tipi di orbitali vengono designati usando un numero ed una lettera.
l=0 vengono usati la lettera s (sharp)
l=1 vengono usati la lettera p (principal)
l=2 vengono usati la lettera d (diffuse)
l=3 vengono usati la lettera f (fundamental)
Resta da definire la forma degli orbitali.
Per la spiegazione si fa ancora ricorso al tipo di orbita ellittica con semiassi (a) e (b) per cui è ancora valida la relazione:
a/b=(l + 1)/n
dove (l) è per l’appunto la eccentricità.
Facciamo degli esempi.
Es: 1
Per n=1; l=0 ; orbitale (s)
a/b=(0+1)/1=1 semiassi coincidenti, l’orbita (s) è circolare.
Es: 2
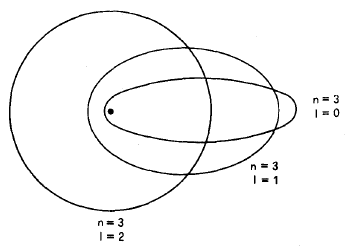
Per n=3; l=0 orbitale (s), l=1 orbitale (p); l=2 orbitale (d).
Si ha:
- n=3; l=0 a/b=(0+1)/3 = 0,33
- n=3; l=1 a/b=(1+1)/3 = 0,66
- n=3; l= 2 a/b=(2+1)/3 = 1
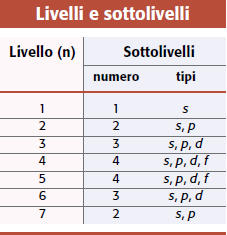
Nella tabella sono mostrati i valori che assume il numero quantico (l) in riferimento dei primo 4 valori id (n)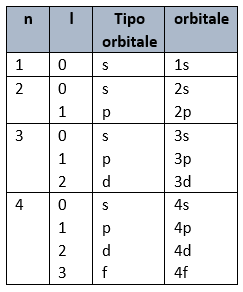
Con n=5 si dovrebbero avere 5 diversi tipi di orbitali, in realtà sono presenti gli stessi orbitali del livello 4 (s, p, d, f).
Con n=6 sono presenti solo gli orbitali s, p, d.
Con n=7 si hanno solo gli orbitali s e p
Successivamente alla teoria quantistica si Bohr fu sviluppata una nuova teoria sulla struttura dell’atomo, nata dalla geniale intuizione di De Broglie della natura ondulatoria dell’elettrone.
L’argomento è assai complesso. Mi limito a dire che De Broglie estese l’assunto di Einstein relativo al fotone dimostrando che ad ogni corpuscolo di massa (m) in moto con velocità (v) è associata un radiazione di lunghezza d’onda data dalla relazione:
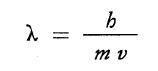
Successivamente O. Stern dimostrò che il concetto di onda associata era valida per ogni forma di materia. Il concetto è estremamente importante. Estendendo il concetto di onda associata all’elettrone-onda associata, possiamo considerare quest’ultima come una onda di probabilità.
L’elettrone descritto come entità ben definita dalla teoria quantistica classica perde la sua individualità nelle teoria ondulatoria nella quale viene delocalizzato in una onda di probabilità.
Con l’introduzione di questi nuovi concetti, il generico elettrone di un atomo, ad esempio l’univo elettrone dell’idrogeno, non è più una particella che ruota attorno al nucleo in un orbita ben localizzata, ma viene considerata come elettricità delocalizzata in una onda.
L’onda associata all’elettrone che si muove circolarmente attorno al nucleo è una onda comprendente un numero intero (n) di lunghezza d’onda (ʎ).
Indicando con (r) la distanza media fra il nucleo e il treno d’onde si può scrivere:
2πr=nʎ
dove ʎ=h/mv.
Si ricava
r=n(h/mv)/2π
che esprime anche la condizione di quantizzazione nella teoria di Bohr.
Questa circostanza rappresenta il primo punto di contatto tra teoria ondulatoria e teoria quantistica.
Nei fenomeni ondulatori di qualsiasi natura è fondamentale la conoscenza dell’equazione dell’onda che descrive l’ampiezza dell’onda stessa in funzione del tempo e della distanza da un punto stabilito come origine dell’onda.
Tale equazione è stata introdotta nel 1926 da E. Schrodinger e descrive la probabilità di trovare una particelle (elettrone ) in un determinato spazio.
In meccanica classica un’onda stazionaria (non dipendente dal tempo) che si sviluppa secondo l’asse x è descritta dalla equazione: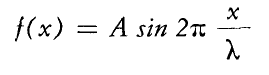
Con ʎ=lunghezza dell’onda stazionaria, A=ampiezza massima dell’onda.
Chiamiamo f(x)=ψ(x) funzione d’onda dell’onda stazionaria.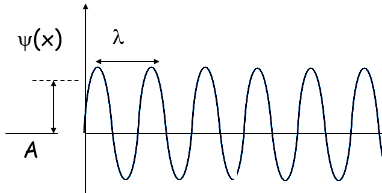
Indicando con ψ(xyz) la funzione d’onda, ovvero l’ampiezza lungo i tre assi dell’onda stazionaria associata all’elettrone la equazione di Schrodinger viene generalmente rappresentata così:
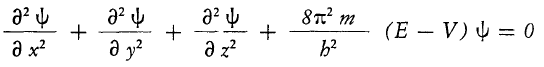
Dove T=mv2/2 è l’energia cinetica dell’elettrone e V la energia potenziale, l’energia totale E=V+T, da cui T=E-V
Che usualmente si scrive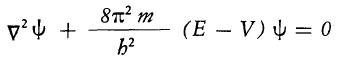
Dove il simbolo ![]() (operatore laplaciano) sta ad indicare la somma delle derivate parziali seconde della funzione rispetto alle coordinata cartesiane x,y,z.
(operatore laplaciano) sta ad indicare la somma delle derivate parziali seconde della funzione rispetto alle coordinata cartesiane x,y,z.
Queste funzioni d’onda ψ(xyz) della teoria ondulatoria dell’atomo, fanno idealmente riscontro alle orbite della teoria quantistica; secondo quest’ultima l’elettrone ruota attorno al nucleo su una orbita definita e con un determinato valore d’energia; secondo la teoria ondulatoria invece l’elettrone viene delocalizzato attorno al nucleo in una definita onda stazionaria ψ cui corrisponde ugualmente un determinato valore di energia.
Per queste analogie formali le ψ prendono comunemente nome di orbitali.
Il numero quantico (m) “determina” gli orientamenti possibili nello spazio degli orbitali ψ rispetto ad un campo di forze esterno all’atomo di cui l’orbitale fa parte.
I valori che (m) può assumere sono i numeri interi che vanno da (-l) a (+l) compreso lo zero (0,±l)
Quindi.
n=1, 2, 3, 4
l=0, 1, 2, 3 (s, p, d, f)
m=0, ±1, ±2, ±3, ……±l
Un orbitale n=2, l=1, m=0 si scrive ψ210
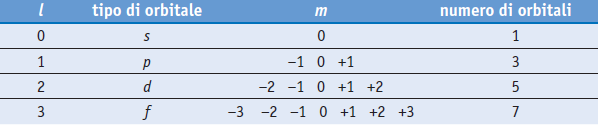
Nella tabella sono mostrati i valori di (m) al variare del numero quantico secondario (l) da 0 a 3 e di conseguenza il numero totale di orbitali che corrispondono ad ogni livello.
Successivi sviluppi teorici portarono P. Dirac ad introdurre un quarto coefficiente detto spin.
Secondo il modello dell’elettrone rotante, lo spin indica il verso di rotazione dell’elettrone sul proprio asse in senso orario e in senso anti orario.
Due elettroni che hanno gli stessi numeri quantici n, l, m (ovvero che occupano lo stesso orbitale ψ) non possono avere lo stesso numero quantico di spin (Principio di esclusione di Pauli) devono cioè vere spin opposto. Ogni orbitale può essere occupato solo da due elettroni con spin che devono essere opposti.
Quando due o più elettroni hanno a disposizione orbitali vuoti, essi tendono ad occuparne il maggior numero possibile disponendosi a spin paralleli.
ms= +1/2, -1/2
Gli orbitali vengono rappresentati graficamente da quadratini. Uno per l’orbitale (s), 3 uniti per l’orbitale (p), 5 per gli orbitali (d), 7 per gli orbitali (f).
Gli elettroni vengono rappresentato con frecce verticali. Ogni orbitale può contenere 0, 1, 2 elettroni. Il verso della freccia indica lo spin. Se l’orbitale è occupato da due elettroni essi devono averi versi opposti ad indicare spin opposti.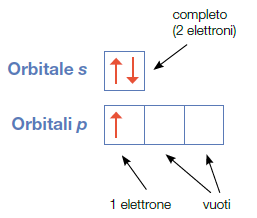
Nella condizione di maggiore stabilità dell’atomo (condizioni di minore energia) gli elettroni tendono ad assumere spin parallelo.
Es: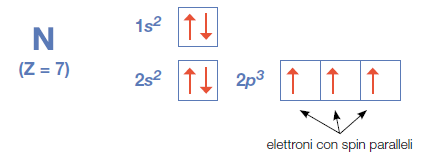

E’ stato detto che dal numero quantico (l) dipende la forma dell’orbitale ψ nello spazio.
Essa infatti descrive forma e densità elettronica della nube di elettricità corrispondente ad un elettrone che si trova sull’orbitale ψ, e sono appunto queste nubi ed il loro orientamento che interessano i legami chimici.
Orbitale (s) (l=0) (m=0)
In ogni livello (n) per l=0 troviamo un solo orbitale s che è sempre sferico.
E’ da sottolineare che i livelli di tipo (s) hanno la stessa forma qualunque sia il livello (n) in cui si trovano. Bisogna altresì sottolineare che l’energia (volume) dell’elettrone cresce a crescere del numero quantico (n). Un elettrone nell’orbitale 1s ha energia inferiore alla energia di un elettrone nell’orbitale 2s.
Orbitale (p) (l=1) (m=0, +1, -1)
A partire dal secondo livello (n=2) ogni livello presenta 3 orbitali ψ differenti ed ortogonali tra loro detti degeneri che possono contenere fino ad un numero massimo di 6 elettroni, due per ogni orbitale.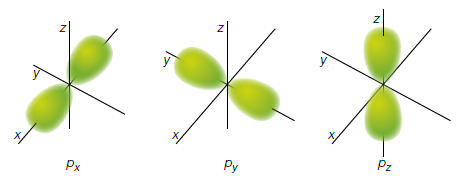
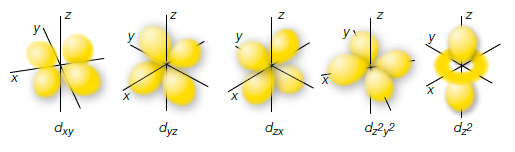
Orbitale (d) (l=2) (m=0, ±1, ±2)
Sono presenti nel 3°, 4°, 5°, 6°, livello con 5 orbitali ψ e possono contenere al massimo 10 elettroni.
Orbitali (f) (l=3) (m=0, ±1, ±2, ±3)
Sono presenti dal 4°, e 5° livello con 7 orbitali ψ e possono contenere al massimo 14 elettroni.
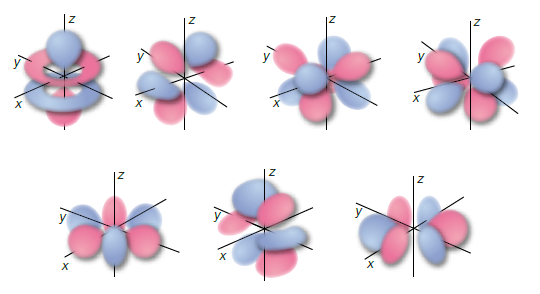
Esempio:
Scrittura della struttura dell’atomo.
La struttura dell’atomo può essere scritta servendosi di alcune convenzioni.
Prendiamo come esempio l’atomo di ossigeno.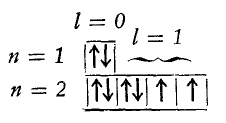
Si ottiene:![]()
Così la configurazione elettronica dell’elio (He, numero atomico 2)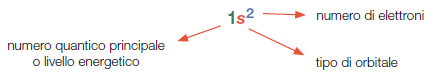

Così per l’arsenico.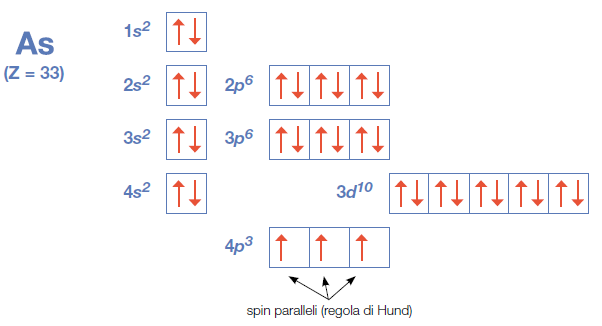
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3

