
| cosa è la meccanica quantistica e cosa studia |
| quando nasce la fisica quantistica |
| il principio di indeterminazione di Heisenberg |
| la equazione di Schrödinger |

La meccanica quantistica
La meccanica quantistica è la branca della fisica che spiega i fenomeni atomici e subatomici nell’infinitamente piccolo.
Studia le particelle, i nuclei degli atomi, o in generale i corpi con dimensioni uguali o inferiori a 10-10 metri.
La meccanica quantistica non sostituì integralmente la precedente teoria. Venne applicata per spiegare soltanto una parte dei fenomeni naturali, quelli microscopici ( es. particelle subatomiche ). I fenomeni macroscopici continuarono a essere interpretati dalla meccanica fisica classica. 
Quando nacque la meccanica quantistica?
Il primo a cercare una spiegazione diversa ai fenomeni naturali microscopici fu il fisico tedesco Max Planck agli inizi del Novecento. Nel 1900 Planck elaborò la teoria dei quanti e introdusse il concetto di quanto di energia. Secondo Planck l’energia è quantizzata come le cariche elettriche. L’energia viene emessa in quantità discrete, multipli interi di un quanto di energia universale.
La nuova generazione di fisici adottò la teoria di Planck per indagare sui fenomeni microscopici che apparentemente non seguivano le regole della teoria fisica classica. 
Il principio di indeterminazione di Heisenberg
Heisenberg lavorava a una formulazione matematica della meccanica quantistica negli stessi anni in cui Schrodinger stava lavorando alla sua. Nonostante abbiano preso strade diverse, le due formulazioni matematiche di Schrodinger e Heisenberg portarono allo stesso risultato e diedero la stessa spiegazione dei fenomeni quantistici. Heisenberg partì dal suo principio di indeterminazione secondo il quale:
è impossibile determinare contemporaneamente la posizione e la velocità di una particella.
Pertanto, Heisenberg abbandonò qualsiasi tentativo di utilizzare le leggi della meccanica classica per studiare l’atomo quantistico.
Non potendo misurare il moto delle particelle, Heisenberg concentrò la sua attenzione sul salto di energia degli elettroni. Questo momento era l’unico a poter essere osservato e descritto.
Dal punto di vista formale, Heisenberg descrisse il comportamento degli elettroni tramite quantità discrete di energia, utilizzando le matrici matematiche. La formulazione matematica della meccanica quantistica di Heisenberg permette, comunque, di giungere agli stessi risultati ottenibili con la formulazione di Schrodinger. Le sue formulazioni sono considerate equivalenti. Anche Heisenberg considera la posizione e il moto della particella come un dato probabilistico.
In altri termini, non si può stabilire con certezza dove si trova una particella e quale sia il suo moto, bensì dove probabilmente si trova e quale comportamento dinamico sta rispettando. Si tratta, quindi, di un calcolo più statistico che matematico. Del resto, con Heisenberg nacque il paradigma scientifico dell’incertezza, un principio contrapposto alla certezza deterministica della scienza ottocentesca.
La spiegazione del principio di indeterminazione. La natura corpuscolare della luce pone un limite alla misurabilità, al di sotto del quale è impossibile andare. Per studiare una particella elementare dobbiamo illuminarla. Tuttavia, la luce è composta da altre particelle corpuscolari ( fotoni ) con un ordine di grandezza paragonabile a quelle da studiare. Quando si illumina la materia, l’urto dei fotoni della luce sulle particelle elementari del corpo ne modifica la loro posizione e velocità di origine.
Il principio di indeterminazione è un fenomeno intrinseco della natura, non dipende del tipo di particella o dalle tecniche di osservazione. 
Equazione di Schrödinger
Nella fisica atomica l’equazione di Schrödinger è una formula per descrivere la posizione e il moto degli elettroni intorno al nucleo, tramite una funzione d’onda.
Secondo Schrödinger, le particelle subatomiche con carica negativa ( elettroni ) non occupano delle orbite circolari prestabilite intorno all’atomo. Nell’atomo di Bohr l’elettrone segue un’orbita circolare. Tuttavia, il suo modello di riferimento è l’atomo di idrogeno che notoriamente ha un solo elettrone (numero atomico uguale a uno). Il problema sorge quando l’atomo ha più elettroni. In questo caso, tra gli elettroni si interpone una forza di repulsione coulombiana ( forza di Coulomb ) che ne modifica.
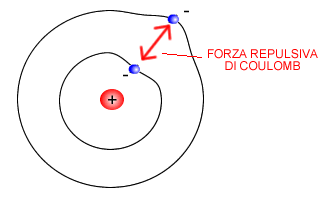
In conclusione, le orbite degli elettroni non possono essere determinate con le leggi della fisica classica.
Erwin Schrödinger propose di abbandonare ogni tentativo di misurazione degli elettroni con le leggi della meccanica classica e adottare un’interpretazione probabilistica tramite le leggi della meccanica quantistica.
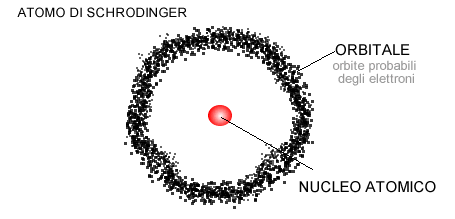
Schrödinger elaborò un’equazione per calcolare le onde di probabilità, ossia le orbite intorno al nucleo ove l’elettrone potrebbe orbitare con maggiore probabilità. L’insieme delle onde di probabilità individua una regione dello spazio atomico, detta orbitale atomico, nella quale “probabilmente” si muovono gli elettroni.
Con l’equazione di Schrödinger venne abbandonata la rappresentazione dell’atomo come modello planetario di Niels Bohr. Nessuno poteva più confermare con certezza l’idea di Bohr dell’orbita circolare degli elettroni.
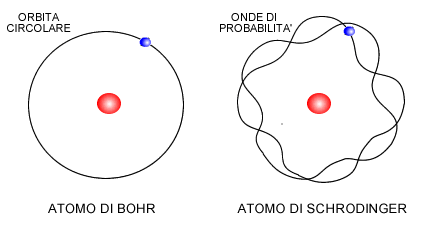
Piuttosto, l’atomo cominciò a essere immaginato come un nucleo circondato da regioni dello spazio atomico in cui si concentrano delle nubi elettroniche, ove si spostano gli elettroni.
Mi domandate qual’è la formula? Eccola, ma non ve la spiego tanto non serve:
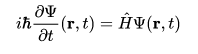

Cos’è l’operatore hamiltoniano? Per i più pignoli l’operatore hamiltoniano 

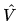 ,
, 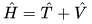 .
.

